submit™プラットフォームは、医薬品開発業務受託機関(CRO)とスポンサー向けに、SENDデータセットと関連文書の作成と管理のための統合されたツールとサービスのスイートを提供します。
SENDフォーマットは、非臨床データのレビューをより効率的に行い、データの品質、アクセス性、予測可能性を向上させます。この規格自体は、標準的な規制毒性試験の大部分の結果を規制当局へより簡単に運搬するための媒体を提供するように設計されています。
規制当局提出資料と毒物検査データの電子交換の両方のためのSENDの導入は業界に大きな影響を与えており、規制当局提出資料を電子フォーマットで提供するためのFDA SENDマンデートが発効した今、組織はNDA、ANDA、IND、および特定のBLAの提出物のためにFDAデータ標準カタログで指定されているFDA対応の適切な標準、フォーマット、および用語を使用しなければなりません。このマンデートに従わないと、FDAによる技術的な拒絶や提出の拒否につながる可能性があるため、組織がSENDに準拠していることが非常に重要です。
2019年3月15日現在、SEND 3.1の規制採用基準では、生殖毒性試験や安全性薬理試験などの新しい試験タイプが追加されています。
この変化の期間にあって、スポンサーやCROは、SEND準拠になる選択肢の増加に直面しています。それは評価が複雑になる可能性があり、まだ市場で本当に試験されておらず、SENDレディネスの段階に本当に適合していません。
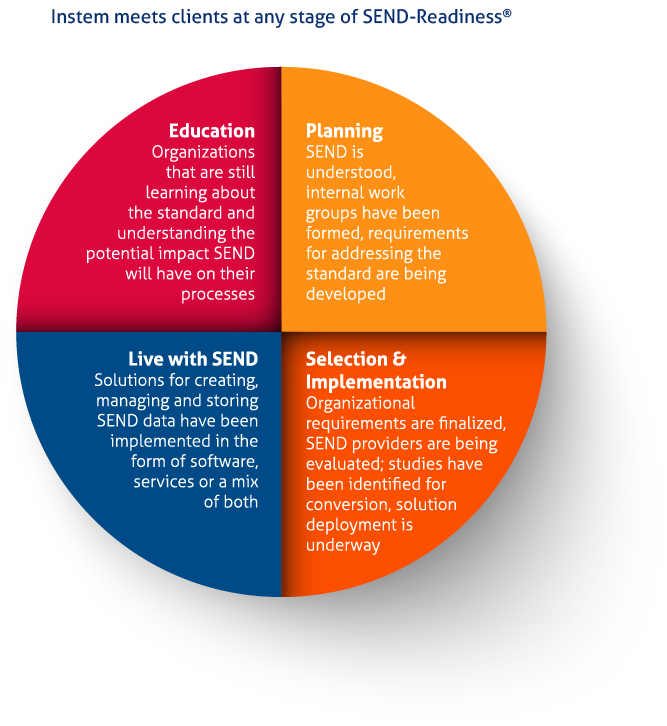
Instemは、企業の標準化準備を支援してきた豊富な経験を活かし、実際的で実用的な実証済みのソリューションを用いて、レディネスのどの段階でも明確なSENDガイダンスを組織に提供しています。Instemの送信用のツールと外部委託サービスのスイートは、現在、15カ国の市場で最も広く採用されているSENDソリューションです。
Submit ソフトウェア
Submitは、SENDデータのメーカーと消費者の両方のニーズに対応しています。しかし、私たちは多くの組織が運用の過程でSENDデータを作成したり、消費したりしていることを認識しながら、Submitを開発しました。また、最大規模の多国籍製薬企業やCROのニーズから、小規模な組織やその顧問先まで、非常に幅広いニーズに対応しています。
Submit™の特徴と機能には以下のようなものがあります。
|
研究開発プログラムを前進させるためにSENDを利用して規制当局提出資料を出す場合でも、安全性データを活用して新たな知見を得るための媒体としてSENDを利用する場合でも、Instemは必要なサポートを提供することができます。当社のデータ管理および分析製品は高機能で、データマイニングだけでなく、規制上のクエリにも対応するように設計されています。SENDのワークフロー管理は、必要に応じてSENDデータのデータリポジトリへの流れおよび(または)規制当局提出資料への流れを自動化することができます。
Submit サービス
FDAへの調査所見提出のためのSENDの導入は、機会と課題を同様に業界に提示します。InstemのSENDの専門家は、クライアントがSENDレディになるため組織化、教育、指導を支援し、SENDのメリットを最大限に発揮するための具体的なアプローチを特定し、規制ガイダンスを確実に遵守するようにします。
SENDレディネスの各段階において、クライアントは、組織内での影響を最小限に抑えながら、SEND準拠への道のりを支援する1つまたは複数のソリューションサービスから選択することができます。これには、全面的に外部委託したSEND部門として組織が完全にInstemを利用するオプションが含まれています。