クリティカル・パス・イニシアチブに端を発し、非臨床および臨床研究データとメタデータの取得、交換、提出、アーカイブに対応するための規格を策定する非営利団体であるCDISC(臨床データ交換規格コンソーシア)(www.cdisc.org)の支援のもとに開発されました。CDISC(臨床データ交換規格コンソーシア)の使命は、医学研究と医療関連分野を改善するための情報システムの相互運用性を可能にする、プラットフォームに依存しないグローバルなデータ標準を開発し、これに対応させることです。
SEND Status
2017年12月17日、規制当局提出資料を電子形式で提供するためのFDA SEND 3.0 マンデートが発効しました。すべての組織は現在、NDA、ANDA、IND、および特定の BLA 提出のための FDA データ標準カタログで指定された適切な FDA対応の規格、フォーマット、および用語を使用する必要があります。
2019年3月現在、SEND 3.1はFDA提出用に必要とされており、このバージョンではSENDの範囲が安全性薬理学を含むように拡張されていると見られています。
SENDフォーマットは、非臨床データのレビューをより効率的に行い、データの品質、アクセス性、予測可能性を向上させます。
規格自体は、スポンサー、CRO、ソフトウェアベンダーの代表者からなる専門家チームによって、過去数年間に渡って開発されてきました。それは、標準的な規制毒性研究デザインの大部分の結果を規制当局へ運搬するための媒体を提供するように設計されています。規格は、より多くの研究タイプへの対応を追加したり、規格の実用化に伴う変化を取り入れたりして、常に展開しています。

|
利用可能なリソース |

規格には3つの原則の構成要素があります:規格の構造の定義-ドメイン、変数など-、管理された専門用語のライブラリー(変数の一部で使用できる語彙を管理します)、および一連のSENDデータセットのソースとコンテンツを記述したメタデータファイルです。管理された専門用語はCDISC(臨床データ交換規格コンソーシア)チームによって管理され、NIHのウェブポータルを通じて配信されており、四半期ごとに新しい語彙が公開されています。
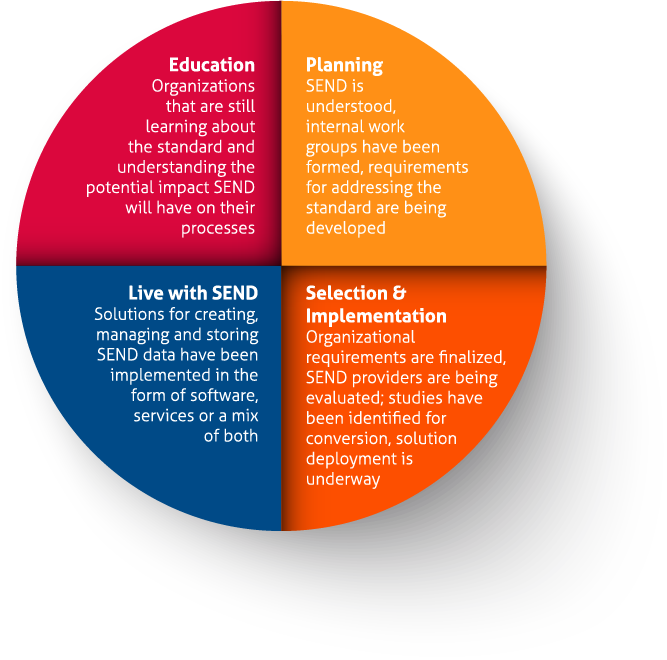
規制当局提出資料と毒物検査データの電子交換の両方にSENDが導入されたことは、業界に大きな影響を与えています。医薬品の早期開発バリューチェーンの各組織は、現在、この規格の実施に影響されており、そのシステムと作業慣行を変更する必要があります。
SENDでのコンプライアンス違反は、申請を拒否される可能性があることを知っていましたか?
Instemがどのように役立つかを知ってください。
Instemは30年以上にわたり前臨床毒性学のコミュニティに貢献してきましたが、規制当局提出資料のためのSEND規格の実施は、FDAに提出するすべての組織、およびそのサプライヤーやコンサルタントに影響を及ぼすことを認識していました。今回初めて、すべての医薬品開発スポンサーは、GLP (優良試験所規範)および21 CFR Part 11の電子記録に関する規制の対象となる電子データを保有し、管理する必要があります。
私たちは、製薬、受託研究、規制当局のコミュニティのパートナーと肩を並べて、創業以来、SENDの創設に時間と資金を投資してきました。私たちは、SENDのパイロット組織やFDAと密接に協力し、さまざまなSEND業界のチームの一員として、規格をさらに定義し、業界の慣行に沿ったものにするために貢献してきました。 私たちは、最も優秀で献身的な人々と協力してSEND規格の創設を支援してきたことを誇りに思っています。
Instemは、SEND実施ガイドの完成に向けた当社の貢献が臨床データ交換規格コンソーシアCDISC(臨床データ交換規格コンソーシア)によって評価され、FDAが発行するガイダンスの草案作成に大きく貢献しました。
SENDReady™になるための次のステップに進み、今すぐご連絡ください。
また、 こちらのページでは、submit™ for SENDのページをご覧いただけます。